
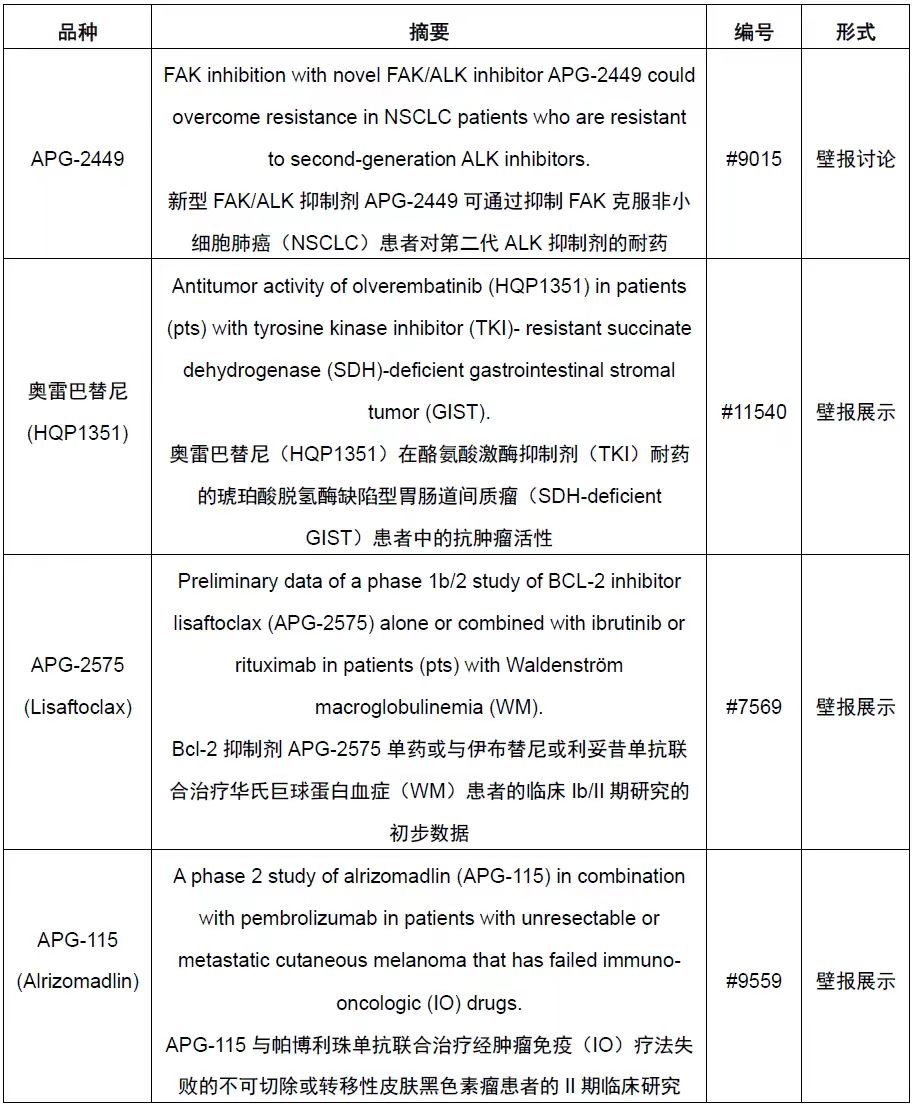
新闻动态
亚盛医药(6855.HK)今日宣布,公司已在第59届美国临床肿瘤学会(ASCO)年会上,以壁报展示形式公布了Bcl-2抑制剂APG-2575单药或与伊布替尼或利妥昔单抗联合治疗华氏巨球蛋白血症(WM)患者的临床Ib/II期研究的初步数据。这是公司细胞凋亡管线重点品种APG-2575在WM领域的全球多中心临床研究进展的首次公布。
今年是亚盛医药连续第六年亮相ASCO年会,此次公司共有4个原研品种的4项临床研究入选。其中,APG-2575相关的该项临床研究数据再一次验证了其在单药治疗和联合疗法中良好的安全性和有效性。数据显示,APG-2575联合伊布替尼在初治的WM患者中的总缓解率(ORR)达100%,且耐受良好、不良反应(AE)可控,在每日剂量递增给药方式(固定3天)下,肿瘤溶解综合征(TLS)风险低;且与伊布替尼无潜在的药物-药物相互作用(DDI)风险。
WM是一种罕见的、惰性的、不可治愈的B淋巴浆细胞性肿瘤。目前多采用以布鲁顿酪氨酸激酶抑制剂(BTKi)或利妥昔单抗为基础的治疗方案。但对于一线治疗耐药或不耐受,以及治疗缓解后复发的患者,尚无受广泛认可的治疗方案。目前在WM领域,尚未有任何一款Bcl-2抑制剂获批。
该项临床研究的主要研究者、梅奥医学中心Sikander Ailawadhi博士表示:“APG-2575是一种高选择性的Bcl-2抑制剂,能诱导细胞凋亡,抑制细胞生长。在该项Ib/II期全球临床研究中,APG-2575单药治疗初步显示对既往接受过BTKi的复发/难治(R/R)WM患者的抗肿瘤活性以及良好的安全性,联合BTKi治疗有100%的患者可以获得缓解,此外,每日剂量递增的给药方式能更快达到目标治疗剂量,且对患者更为友好。我们期待进一步评估APG-2575单药或联合治疗WM患者的疗效和安全性。”
亚盛医药首席医学官翟一帆博士表示:“此次在ASCO年会上展示的APG-2575治疗WM的临床数据再一次表明该品种在血液肿瘤领域强劲的单药和联合治疗潜力。特别值得关注的是,APG-2575在与BTKi伊布替尼联合治疗中显示出非常高的ORR,展现极具潜力的临床前景,令我们备受鼓舞。我们将积极推进该品种的临床开发,加速推向市场,期待早日惠及全球患者。”
APG-2575在此次ASCO年会上展示的核心要点如下:
Preliminary data of a phase 1b/2 study of BCL-2 inhibitor lisaftoclax (APG-2575) alone or combined with ibrutinib or rituximab in patients (pts) with Waldenström macroglobulinemia (WM).
Bcl-2抑制剂APG-2575单药或与伊布替尼或利妥昔单抗联合治疗华氏巨球蛋白血症(WM)患者的临床Ib/II期研究的初步数据
摘要编号:#7569
壁报编号:#120
分会场标题:血液肿瘤——淋巴瘤及慢性淋巴细胞白血病(Hematologic Malignancies—Lymphoma and Chronic Lymphocytic Leukemia)
核心要点:
本研究是一项开放性、全球多中心的Ib/II期研究,旨在评估新型、口服、高选择性的Bcl-2抑制剂APG-2575(Lisaftoclax)作为单药或与伊布替尼或利妥昔单抗联合使用治疗WM患者的安全性、耐受性、有效性和药代动力学(PK)。
截至2023年4月12日,共入组46例患者。患者被分为如下三组,
A组:APG-2575单药治疗BTKi耐药/不耐受患者(n = 14);
B组:APG-2575联合伊布替尼给药治疗初治患者(n = 24);
C组:APG-2575联合利妥昔单抗治疗复发/耐药,且既往未接受过伊布替尼及其他BTKi治疗的患者(n = 8);
该研究使用毒性概率区间-2(mTPI-2)试验设计,APG-2575剂量从400mg递增至最高1200mg。其中,A组剂量递增至1000 mg;B组剂量递增至1200mg;C组剂量递增至800mg。
疗效:A组ORR(微小缓解及以上)为50%,中位缓解时间(MTTR)为4.6(1-9)个月;B组ORR为100%,MTTR为1(1-5)个月,C组ORR为62.5% ,MTTR为4.4(1-10)个月。其中B组两例患者达到非常好的部分缓解(VGPR),其中位至VGPR时间为3.1(1.8-4.4)个月。未观察到CXCR4突变对疗效的负面影响。
安全性:目前APG-2575尚未达到最大耐受剂量。B组在递增至1200mg时,观察到1例剂量限制毒性(DLT, 3级临床TLS),考虑主要与自身既往存在的肾功能损害相关。未见室性心律失常。1例患者因AE导致APG-2575用药减量,2例因AE停药。常见的与APG-2575相关的AE(>10%)包括:中性粒细胞减少症(36.9%)、腹泻(34.8%)、白细胞减少症(21.7%)、恶心(13%)、贫血(13%)、腹痛(10.9%)、血小板降低(10.9%)以及食欲减退(10.9%)。其中绝大多数为1/2级的不良反应。PK数据显示APG-2575与伊布替尼无潜在的DDI风险。
结论:APG-2575单药,或与伊布替尼或利妥昔单抗联合在初治或既往BTKi治疗失败的WM患者中安全性好,且与伊布替尼联合治疗无DDI风险,展现出令人鼓舞的疗效。
附:亚盛医药在本届ASCO年会展示的包括APG-2575在内4个品种的多项最新临床试验进展包括:
关于亚盛医药
亚盛医药是一家立足中国、面向全球的生物医药企业,致力于在肿瘤、乙肝及与衰老相关的疾病等治疗领域开发创新药物。2019年10月28日,亚盛医药在香港联交所主板挂牌上市,股票代码:6855.HK。
亚盛医药拥有自主构建的蛋白-蛋白相互作用靶向药物设计平台,处于细胞凋亡通路新药研发的全球前沿。公司已建立拥有9个已进入临床开发阶段的1类小分子新药产品管线,包括抑制Bcl-2、IAP 或 MDM2-p53 等细胞凋亡通路关键蛋白的抑制剂;新一代针对癌症治疗中出现的激酶突变体的抑制剂等,为全球唯一在细胞凋亡通路关键蛋白领域均有临床开发品种的创新公司。目前公司正在中国、美国、澳大利亚及欧洲开展40多项I/II期临床试验。
用于治疗慢性髓细胞白血病的核心品种奥雷巴替尼(商品名:耐立克®)曾获中国国家药品监督管理局新药审评中心(CDE)纳入优先审评和突破性治疗品种,并已在中国获批,是公司的首个上市品种。目前,耐立克®已被成功纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2022年)》。该品种还获得了美国FDA快速通道资格、孤儿药资格认定、以及欧盟孤儿药资格认定。
截至目前,公司共有4个在研新药获得16项FDA和1项欧盟孤儿药资格认定,2项FDA快速通道资格以及2项FDA儿童罕见病资格认证。公司先后承担多项国家科技重大专项,其中“重大新药创制”专项5项,包括1项“企业创新药物孵化基地”及4项“创新药物研发”,另外承担“重大传染病防治”专项1项。
凭借强大的研发能力,亚盛医药已在全球范围内进行知识产权布局,并与UNITY、MD Anderson、梅奥医学中心和Dana-Farber癌症研究所、默沙东、阿斯利康、辉瑞等领先的生物技术及医药公司、学术机构达成全球合作关系。公司已建立一支具有丰富的原创新药研发与临床开发经验的国际化人才团队,同时,公司正在高标准打造后期的商业化生产及市场营销团队。亚盛医药将不断提高研发能力,加速推进公司产品管线的临床开发进度,真正践行“解决中国乃至全球患者尚未满足的临床需求”的使命,以造福更多患者。
前瞻性声明
本文所作出的前瞻性陈述仅与本文作出该陈述当日的事件或资料有关。除法律规定外,于作出前瞻性陈述当日之后,无论是否出现新资料、未来事件或其他情况,我们并无责任更新或公开修改任何前瞻性陈述及预料之外的事件。请细阅本文,并理解我们的实际未来业绩或表现可能与预期有重大差异。本文内所有陈述乃本文章刊发日期作出,可能因未来发展而出现变动。